Os equilíbrios ceto-enólicos refletem um delicado equilíbrio termodinâmico entre as duas formas.

As diferenças de ligação entre as estruturas ceto e enol mostrados acima são:
ceto: C = O ligação dupla, CC ligação simples, ligação CH
enol: C = C ligação dupla, CO ligação simples, ligação OH
Se procurarmos as energias de ligação para essas ligações, encontramos
ceto: 745 + 347 + 413 = 1505 kJ / mol
enol: 614 + 358 + 467 = 1439 kJ / mol
Este cálculo aproximado nos diz que, geralmente, a forma ceto irá predominar. No entanto, a diferença de energia entre as duas formas é de apenas 66 kJ / mol, um número relativamente pequeno; portanto, é provável que pequenas diferenças possam causar uma mudança dramática nas concentrações relativas das duas espécies.
Algumas diretrizes gerais para prever mudanças no equilíbrio ceto-enol
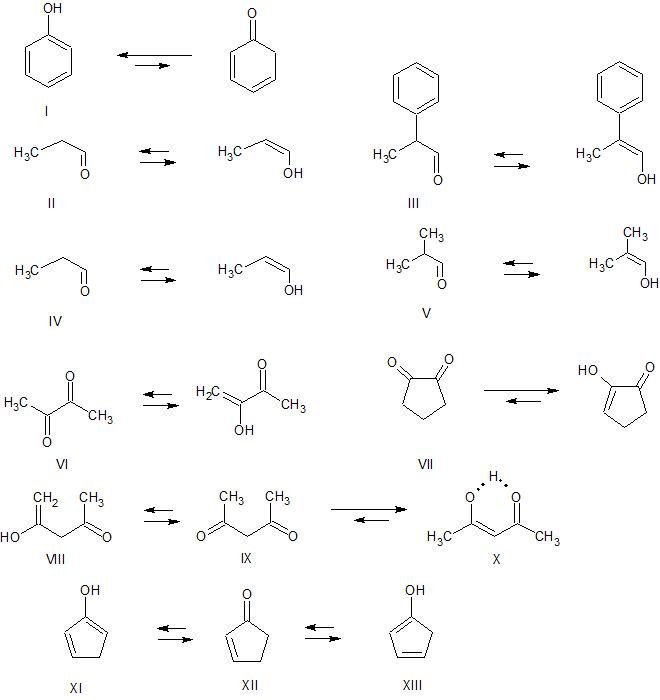
Aromaticidade e conjugação - O equilíbrio ceto-enol para o fenol (I) está totalmente no lado do enol devido à estabilização termodinâmica fornecida pela aromaticidade. Seria esperado que o composto III tivesse um teor de enol mais alto do que o composto II devido à conjugação estendida presente no enol de III
Substituição - substituir hidrogênio por grupos alquil em uma ligação dupla estabiliza a ligação dupla. Portanto, esperaríamos que o composto V tivesse um teor de enol maior do que o composto IV
Repulsão dipolar - Os dipolos de carbonila em butano-2,3-diona (VI) podem reduzir sua repulsão eletrostática adotando a geometria retratada com os grupos carbonil orientados longe um do outro. Devido às restrições do anel de 5 membros, o ciclopentano-1,2-diona (VII) não pode adotar uma geometria semelhante. Nesse caso, a repulsão dipolar é diminuída pelo aumento do conteúdo de enol no equilíbrio até um ponto em que o enol predomina.
Ligação de hidrogênio - a ligação de hidrogênio pode estabilizar a forma enol. Se a ligação de hidrogênio for forte o suficiente, e particularmente se outros fatores também estabilizarem a forma enol, a forma enol pode predominar. Sua molécula, 2,4-pentanodiona (IX), é um bom exemplo. Existem duas formas possíveis de enol, VIII e X. X é de longe o enol predominante, pois tem 1) conjugação estendida e 2) substituição na ligação dupla carbono-carbono. Além disso, X pode formar uma ligação de hidrogênio muito estável envolvendo uma estrutura de 6 membros entre os dois átomos de oxigênio.
Efeitos do solvente - Especialmente nos casos em que a ligação de hidrogênio está envolvida na estabilização do enol, o solvente pode ter um efeito dramático. No benzeno, onde predomina a ligação de hidrogênio intramolecular, a razão IX: X é de aproximadamente 5:95. Na água, onde a ligação de hidrogênio intramolecular é substituída por uma ligação de hidrogênio ao solvente, a proporção é praticamente invertida.
Resposta à sua pergunta
Ciclopent- A 2-enona pode formar dois enóis diferentes, XI e XIII. Nenhum dos enol tem quaisquer características que seriam esperadas para fornecer estabilização de enol significativa. Não há mais conjugação do que a encontrada na cetona, não há nenhuma ligação especial de hidrogênio e nenhuma substituição das ligações duplas carbono-carbono. Na verdade, o rmn do próton da ciclopentenona é o esperado, sem evidência de uma quantidade significativa de enol. Por outro lado, 2,4-pentanodiona existe principalmente como a forma enol, pelo menos em solventes não polares, pelas 3 razões (conjugação, ligação de hidrogênio, substituição de ligação dupla) discutidas acima.
Como à parte, você mencionou que um anel de 5 membros com duas ligações duplas (um ciclopentadieno) pode não ser muito estável; na verdade, eles são bastante estáveis e comuns, 2 ligações duplas em um anel de 5 membros não criam muita tensão.